Des cancers du sein traités par l’anticorps conjugué T-DXd
CONGRÈS ESMO Deux études présentées à l’ESMO 2025 tendent à confirmer l’efficacité du trastuzumab deruxtecan (T-DXd) dans le traitement de certains cancers HER2+. Le bénéfice sur la survie semble déjà certain en adjuvant, et le sera probablement aussi en néoadjuvant.
En Belgique, le trastuzumab emtansine (T-DM1) est actuellement le seul anticorps conjugué approuvé pour le traitement adjuvant du cancer du sein HER2+ de stade précoce qui n’a pas répondu complètement à la chimiothérapie néoadjuvante combinée au blocage HER2. Quant au trastuzumab deruxtecan (T-DXd), il est remboursé depuis 2023, mais seulement en stade métastatique. Il s’agit aussi d’un anticorps conjugué à un médicament cytotoxique, qui cible spécifiquement les cellules tumorales HER2.
Le T-DXd en stade précoce
Or, les patientes présentant un cancer du sein HER2+ précoce avec maladie résiduelle après traitement néoadjuvant sont à haut risque de récidive.
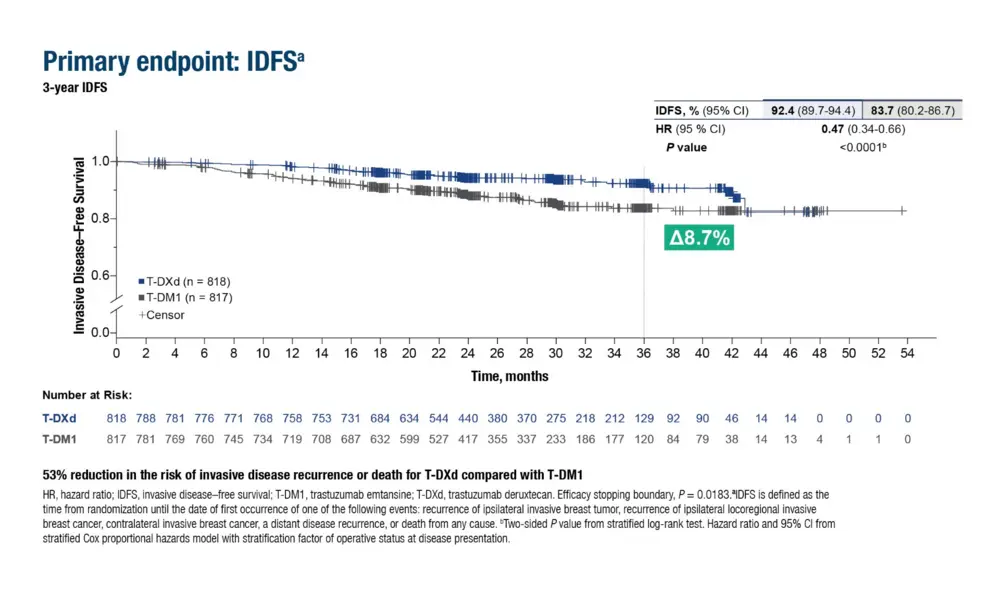
L’étude de phase III DESTINY-Breast05 a donc comparé les deux anticorps conjugués dans une cohorte randomisée de 1.635 patientes dans ce cas de figure. Chaque bras a reçu 14 cycles de traitement en adjuvant.
Après trois ans de suivi et avec un HR de 0,47, le bras de T-DXd s’avère supérieur au niveau de la survie sans maladie invasive (IDFS) : 92,4 % contre 83,7% dans le bras T-DM1 ou, en pourcentage d’événement, 7,6% versus 16,3% [1]. Soit deux fois moins. « Ces résultats tendent à indiquer que la survie globale sera meilleure », commente la Dre Laurence Buisseret, oncologue à l’Institut Jules Bordet - H.U.B. « Ceci ouvre la voie à l’usage et le remboursement du T-DXd dans les stades plus précoces de la maladie, mais nous parlons ici de patientes à haut risque de récidive, qui présentent de grosses tumeurs et/ou un envahissement ganglionnaire au diagnostic. »
Attention aux toxicités
« Cela étant dit, toutes ne devraient pas forcément bénéficier du T-DXd, à cause des toxicités. » C’est, en effet, le bémol de DESTINY-Breast05 : si des toxicités de grade 3 ou plus surviennent une fois sur deux dans chaque bras, le risque majeur reste les pneumopathies interstitielles inflammatoires, notablement plus nombreuses sous T-DXd (2) : 9,6 % Vs 1,6 % sous T-DM1.

« Avec le T-DXd, il faut donc réaliser des scanners thoraciques tous les deux mois afin de détecter au plus tôt une éventuelle pneumonie. Au final, ce serait un traitement à réserver aux patientes les plus à risque de récidive afin que la balance risques-bénéfices reste favorable. Il faudrait aussi étudier si une année de traitement est vraiment nécessaire ou si des schémas plus courts pourraient se révéler moins toxiques et aussi efficaces. »
Une stratégie néoadjuvante sans anthracycline
L’étude DESTINY-Breast11 a, quant à elle, évalué le T-DXd (4 cycles) avant la chirurgie dans les cancers HER2+ précoces à haut risque (≥T3 ou N1–3 ou inflammatoires). À l’origine, le design de l’essai comptait trois bras :
- Le trastuzumab deruxtecan seul (T-DXd) ;
- Le T-DXd, suivi de paclitaxel + trastuzumab + pertuzumab (THP) ;
- Le traitement standard actuel avec anthracyclines, c’est-à-dire la doxorubicine à doses denses (toutes les deux semaines) + cyclophosphamide (ddAC), suivi de THP.
« Faute de réponse positive, ils ont vite abandonné le premier bras, celui du T-DXd en monothérapie », explique la Dre Buisseret. Restaient donc le bras des 4 cycles de chimiothérapie ciblée en néoadjuvant, suivi de la chimio THP, et le bras du traitement standard. Le taux de réponse complète (pCR) est clairement en faveur de la combinaison T-DXd-THP : 67,3 % contre 56,3 %. Soit une différence significative de 11,2 %.
Les toxicités sont également moindres avec la nouvelle approche - 37,5 % de toxicités de grade 3 ou plus avec la combinaison, contre 55,8 % avec les anthracyclines - et aussi moins de cardiotoxicité : 1,9 % Vs 9 %. « Dans notre pratique, nous pourrions appliquer ce nouveau protocole qui permet la désescalade des anthracyclines - encore indiquées dans les stades localement avancés au diagnostic -, mais nous ne connaissons pas encore l’impact sur la survie globale », rappelle la Dre Buisseret. « Certes, l’EFS semble favorable (HR 0,56), mais il faut voir si cette tendance positive se confirmera dans le temps. »
Une note POSITIVE
Les données actualisées de l’étude POSITIVE ont été présentées à l’ESMO. Pour rappel, celle-ci suit 518 patientes – dont des Belges – guéries d’un cancer du sein HR+ et qui ont interrompu leur hormonothérapie 18 à 30 mois pour concevoir un bébé.
Après un suivi médian de 71 mois et en comparant avec une autre cohorte (SOFT/TEXT), aucun excès de récidive n’a été observé. En effet, l’intervalle sans cancer du sein (BCFI) et l’intervalle sans rechute à distance (DRFI) sont respectivement de 12,3 % et 6,2 % chez les patientes de POSITIVE, contre 13,2 % et 8,3 % dans le groupe contrôle.
Notons également un taux de grossesse de 75,8 % et un taux de naissances vivantes de 69 %, soit 440 nouveau-nés. Une très bonne nouvelle pour toutes les patientes sous hormonothérapie qui désire concevoir un bébé après leur cancer.
Remarques:
1. La survie sans maladie (DFS) suit la même tendance : HR 0,47.
2. Deux décès ont d’ailleurs été déplorés dans ce bras.