Borstkanker behandeld met de geconjugeerde antistof T-DXd
ESMO-CONGRES Op het ESMO 2025 zijn twee studies gepresenteerd die de werkzaamheid van trastuzumab deruxtecan (T-DXd) bij de behandeling van HER2+ borstkanker bevestigen. Het was al bewezen dat een adjuvante behandeling de overleving verbetert en waarschijnlijk doet een neoadjuvante behandeling dat ook.
Trastuzumab emtansine (T-DM1) is momenteel de enige geconjugeerde antistof die in België is goedgekeurd voor de adjuvante behandeling van HER2+ borstkanker in een vroeg stadium waarbij geen volledige respons wordt verkregen met een neoadjuvante chemotherapie plus een HER2-antagonist. Trastuzumab deruxtecan (T-DXd) wordt sinds 2023 terugbetaald, maar enkel als er metastasen zijn. Ook trastuzumab deruxtecan is een antistof gekoppeld aan een cytotoxisch middel, die specifiek HER2+ tumorcellen aanvalt.
T-DXd in een vroeg stadium
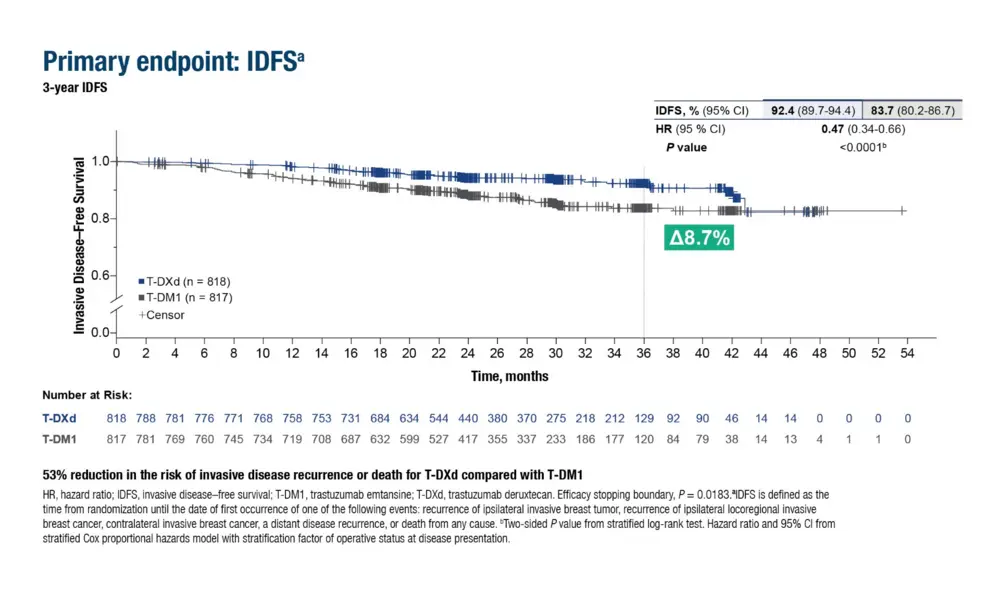
Patiënten met een HER2+ borstkanker in een vroeg stadium met een restziekte na een neoadjuvante behandeling lopen een hoog risico op recidief. De fase III-studie DESTINY-Breast05 heeft de twee geconjugeerde antistoffen vergeleken in een gerandomiseerde studie bij 1.635 patiënten. Elke groep heeft 14 cycli van een adjuvante behandeling gekregen.

Na een follow-up van drie jaar was de overleving zonder invasieve ziekte (IDFS) beter in de T-DXd-groep (HR: 0,47) (92,4% versus 83,7% in de T-DM1-groep) en bedroeg de incidentie van evenementen respectievelijk 7,6% en 16,3%(1). Dus tweemaal minder. “Dat laat vermoeden dat de totale overleving beter zal zijn”, commentarieert dr. Laurence Buisseret, oncologe aan het Bordet Instituut - H.U.B. “Dat effent de weg voor gebruik en terugbetaling van T-DXd in vroegere ziektestadia, maar het gaat hier wel om patiënten die een hoog risico op recidief lopen, die op het ogenblik van de diagnose een grote tumor hebben en/of lymfekliermetastasen.”
Opletten voor toxiciteit
“Maar gezien de toxiciteit is T-DXd niet bij alle patiënten geïndiceerd.” In de DESTINY-Breast05-studie heeft 50% van de patiënten in beide behandelingsgroepen graad ≥ 3-toxiciteit ontwikkeld. Met name de incidentie van inflammatoir interstitieel longlijden was hoger in de T-DXd-groep(2) dan in de T-DM1-groep: respectievelijk 9,6% en 1,6%. “Bij behandeling met T-DXd moet je om de twee maanden een CT-scan van de thorax aanvragen om een eventuele pneumonitis zo snel mogelijk te detecteren. Het is dus beter die behandeling enkel voor te schrijven bij de patiënten die het hoogste risico op recidief lopen. Bij die patiënten kan de risico-batenverhouding gunstig zijn. Ook moet worden nagegaan of het echt nodig is een jaar te behandelen. Misschien is een kortere behandeling minder toxisch en even effectief?”
Een neoadjuvante behandeling zonder antracycline
De DESTINY-Breast11-studie heeft T-DXd (vier cycli) voor chirurgie onderzocht bij patiënten met een HER2+ kanker in een vroeg stadium die een hoog risico op recidief liepen (≥ T3 of N1-3 of inflammatoire tumor). Aanvankelijk werden de patiënten in drie behandelingsgroepen gerandomiseerd:
1. enkel trastuzumab deruxtecan (T-DXd);
2. T-DXd, gevolgd door paclitaxel + trastuzumab + pertuzumab (THP);
3. de huidige standaardbehandeling met een antracycline, d.w.z. doxorubicine in dichte dosering (om de twee weken) + cyclofosfamide (ddAC) gevolgd door THP.
“Bij gebrek aan positieve respons is de eerste behandelingsgroep (T-DXd in monotherapie) snel stopgezet”, legt dr. Buisseret uit. De twee overblijvende groepen waren dus: een neoadjuvante gerichte chemotherapie vier cycli gevolgd door THP en de standaardbehandeling. Het percentage complete respons (pCR) was duidelijk hoger met de combinatietherapie T-DXd-THP: 67,3% versus 56,3%, dus een significant verschil van 11,2%.
De nieuwe behandeling veroorzaakte minder toxiciteit: graad ≥ 3-toxicieit 37,5% met de combinatietherapie en 55,8% met een antracycline. Ook is minder cardiotoxiciteit opgetreden: 1,9% versus 9%. “We zouden dat nieuwe behandelingsschema kunnen toepassen om minder antracyclines te moeten voorschrijven (die zijn nog geïndiceerd in een plaatselijk gevorderd stadium op het ogenblik van de diagnose), maar we kennen het effect ervan op de totale overleving nog niet”, aldus dr. Buisseret. “De EFS is weliswaar beter (HR: 0,56), maar we moeten afwachten of die positieve tendens gehandhaafd blijft.”
Een positieve noot
Op het congres van de ESMO zijn ook de geüpdatete gegevens gepresenteerd van de POSITIVE-studie. Die studie volgt 518 patiënten, onder wie een aantal Belgische, die waren genezen van een HR+ borstkanker en die de hormoontherapie gedurende 18 tot 30 maanden hebben onderbroken om een kind te krijgen. Na een mediane follow-up van 71 maanden was de incidentie van recidief niet hoger dan in een andere cohorte (SOFT/TEXT). Het interval zonder borstkanker (BCFI) en het interval zonder recidief op afstand (DRFI) bedroegen respectievelijk 12,3% en 6,2% in de POSITIVE-studie en 13,2% en 8,3% in de controlegroep. Het zwangerschapspercentage bedroeg 75,8% en het percentage levende geboortes 69% (440 pasgeborenen). Zeer goed nieuws dus voor de patiënten die een hormoontherapie krijgen en na hun kanker een kind willen krijgen.
Opmerkingen:
1. Eenzelfde tendens wat de ziektevrije overleving (DFS) betreft: HR 0,47.
2. Twee patiënten van die groep zijn overleden.