Melanoom en neoadjuvante immunotherapie
ESMO-CONGRES Op het ESMO 2025 zijn studies gepresenteerd waarin betere en langer aanhoudende resultaten bij de behandeling van een plaatselijk gevorderd, reseceerbaar melanoom zijn verkregen met een neoadjuvante immunotherapie. Dat pleit voor een brede klinische implementering van een neoadjuvante immunotherapie.

Bij patiënten met een niet-reseceerbaar melanoom betaalt België ipilimumab (in monotherapie en in combinatie met nivolumab) en pembrolizumab en nivolumab als adjuvante behandeling terug. De klinische studies NADINA en SWOG S1801 en meerdere translationele studies bevestigen de superioriteit van checkpointremmers als neoadjuvante behandeling bij patiënten met een reseceerbaar melanoom met macroscopische metastasen, metastasen die klinisch of radiologisch aantoonbaar zijn (stadium IIIb/c/d of IV volgens de achtste classificatie van het AJCC).
“Daarom pleiten de richtlijnen van de ESMO nu voor een neoadjuvante behandeling”, aldus prof. Bart Neyns, medisch oncoloog aan het UZ Brussel en moderator van de plenaire sessie over melanoom op het congres van de ESMO. “Ook het KCE pleit daarvoor.”
Neoadjuvante behandeling met ipilimumab + nivolumab
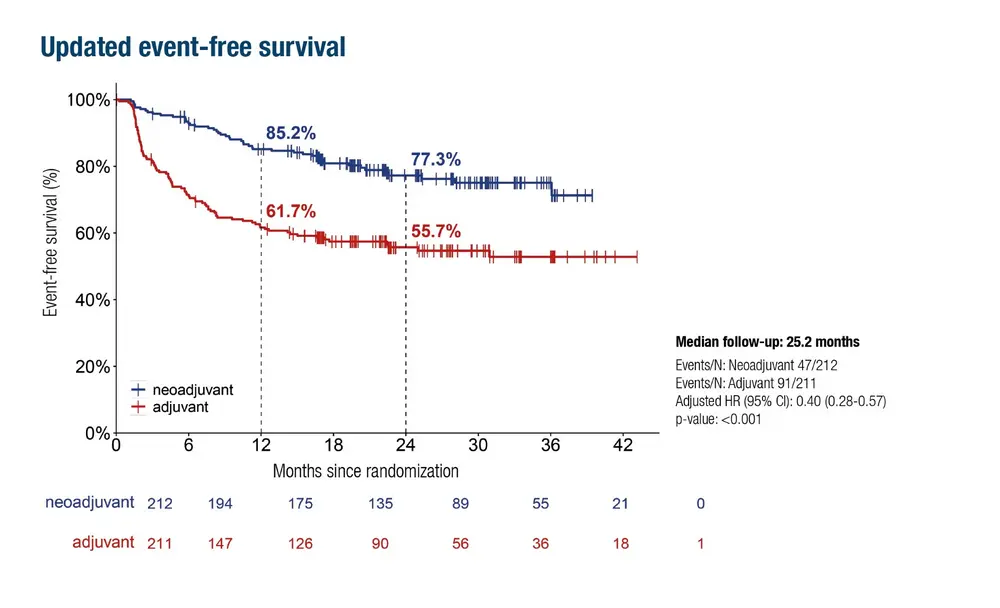
De recentelijk gepubliceerde fase III-studie NADINA (Lucas MW et al., ESMO 2025 LBA57) bevestigt de werkzaamheid van een neoadjuvante behandeling na twee jaar. Ter herinnering, die studie heeft twee cycli van ipilimumab + nivolumab gevolgd door chirurgie (en eventueel een adjuvante behandeling afhankelijk van de pathologische respons) vergeleken met een standaard adjuvante behandeling met enkel nivolumab na resectie. Resultaat na twee jaar: de evenementvrije overleving (EFS) bedroeg 77,3% in de neoadjuvante groep en 55,7% in de adjuvante groep.(1) “Dus een significant verschil van 21% tussen de twee groepen”, aldus prof. Neyns.
“Bij een postoperatief pathologisch-anatomisch onderzoek vertoonde 60% van de patiënten geen levensvatbaar melanoom in de resectieranden meer na twee cycli neoadjuvante immunotherapie. Die patiënten hebben dan ook geen adjuvante behandeling gekregen. Een zeer elegant resultaat.” En financieel beter voor de gemeenschap. Een adjuvante behandeling wordt immers over het algemeen gedurende een jaar gegeven of tot optreden van recidief of onaanvaardbare toxiciteit.
Pembrolizumab als neoadjuvante behandeling
Toevoeging van een neoadjuvante behandeling met pembrolizumab bevestigt de relevantie van die strategie, te oordelen naar de geüpdatete resultaten van de SWOG S1801-studie (Patel SP et al., ESMO 2025, Abstract 1601O). Die fase II-studie heeft pembrolizumab voor en na chirurgie vergeleken met pembrolizumab enkel na chirurgie (adjuvante behandeling) bij patiënten met een melanoom stadium III of IV met macroscopische, reseceerbare metastasen.
Na drie jaar bedroeg de EFS respectievelijk 68% en 56% en de recidiefvrije overleving (RFS) respectievelijk 80% en 60%. Ook de cijfers over de totale overleving zijn veelbelovend (84% vs. 73%), maar die moeten nog op langere termijn worden bevestigd. “De frequentie van graad 3/4-bijwerkingen was overigens vrij vergelijkbaar in de twee groepen: 21% versus 18%. En die neoadjuvante behandeling komt niet duurder uit, aangezien het geneesmiddel dan al gedurende negen weken voor chirurgie zal zijn toegediend.”
De combinatie nivolumab + ipilimumab als adjuvante behandeling
In een Amerikaanse studie (Mitchell TC et al., ESMO 2025, Abstract 1604O) werden de patiënten bij wie geen gunstige pathologische respons werd verkregen met een neoadjuvante behandeling met nivolumab en bij wie de prognose dus slecht was, willekeurig in twee groepen ingedeeld: ipilimumab + nivolumab of enkel nivolumab. “Verrassend is dat de recidiefvrije overleving niet beter was met de combinatietherapie, wat overigens ook al was vastgesteld in een eerdere studie”, commentarieert prof. Neyns.
“Met andere woorden, een neoadjuvante behandeling met een combinatie van twee checkpointremmers in geval van macroscopische, maar reseceerbare metastasen heeft geen zin. En een adjuvante behandeling met een combinatie van twee checkpointremmers als er geen aantoonbare metastasen zijn, brengt evenmin iets bij … tenzij meer toxiciteit.”
Dat is immers het probleem met een combinatietherapie. In de NADINA-studie heeft 31,1% van de patiënten in de neoadjuvante groep graad ≥ 3-bijwerkingen ontwikkeld, dus bijna tweemaal meer dan met een adjuvante behandeling met enkel nivolumab (15,9%). “De patiënten die in aanmerking komen voor die neoadjuvante combinatietherapie, moeten weten dat de waarschijnlijkheid van bijnierinsufficiëntie 7,5% bedraagt (tegen 2% met een adjuvante behandeling).”
Voorspellende biomarkers
Gezien het percentage complete pathologische respons van 60% in de NADINA-studie is het zeker de moeite waard. Bij de andere patiënten is dat dus minder duidelijk. Daarom heeft een Australische groep geprobeerd biomarkers te achterhalen die de respons op een neoadjuvante combinatietherapie voorspellen (Pires da Silva I et al., ESMO 2025, Abstract 117MO). Ze hebben de volgende biomarkers geanalyseerd: de hoeveelheid mutaties in de tumor (tumor mutational burden, TMB), de BRAF-status en de interferon-gammasignatuur (IFNγ), die sterk correleert met de aanmaak van PD-L1.
Een combinatie van twee biomarkers zou een complete respons voorspellen, maar slechts in een fractie van de onderzochte populatie (< 10%). “De correlatie is interessant, maar dat betekent daarom nog niet dat er een oorzakelijk verband is”, denkt prof. Neyns. “Ik zie niet goed hoe we de zoektocht naar biomarkers nu al in de kliniek kunnen toepassen”. De lopende studies ter zake zouden echter in voorkomend geval kunnen uitmonden in een meer gepersonaliseerde behandeling.
Opmerking:
1. De overleving zonder melanoomgerelateerde evenementen (DFMS) na twee jaar, d.w.z. geen recidief van de tumor, gaat in dezelfde zin: 82,8% in de neoadjuvante groep en 63,9% in de adjuvante groep.
Hoop voor patiënten met een gevorderd therapieresistent uveamelanoom
Een uveamelanoom is zeldzaam (5% van het totale aantal melanomen), maar is bijzonder therapieresistent, vooral bij expressie van PRAME (90% van de gevallen). De resultaten van een fase 1-studie met IMA203 (Patel SP et al., ESMO 2025, Abstract 1600O) zijn zo goed gebleken dat de studie op het ESMO mocht worden gepresenteerd tijdens een presidentiële sessie. In die studie heeft een vijftiental patiënten die al zonder succes waren behandeld, een CAR-T-celtherapie gericht tegen PRAME gekregen. Het percentage objectieve respons bedroeg 67%. De mediane duur van de respons was 11 maanden en de mediane totale overleving 16,2 maanden. Bij alle patiënten is de tumor gekrompen. Die bijzonder fraaie resultaten bieden nieuwe hoop bij de behandeling van uveamelanoom. Momenteel wordt een grotere studie op touw gezet.
