Mélanome: l’ESMO 2025 consacre l’immunothérapie néoadjuvante
CONGRÈS ESMO Les données présentées à l’ESMO 2025 font état de résultats supérieurs, durables et compatibles avec une implémentation clinique large de l’immunothérapie néoadjuvante dans la prise en charge des mélanomes résécables localement avancés.

Actuellement, en cas de mélanome non résécable, la Belgique rembourse l’ipilimumab (en monothérapie et en combinaison avec le nivolumab), ainsi que le pembrolizumab et le nivolumab en traitement adjuvant. Or, les essais cliniques NADINA et SWOG S1801, ainsi que plusieurs travaux translationnels, confirment la supériorité des inhibiteurs de points de contrôle immunitaires en traitement néoadjuvant chez les patients atteints de mélanome résécable avec métastases macroscopiques - c’est-à-dire détectables cliniquement ou radiologiquement (stade IIIb/c/d ou IV selon la 8e classification AJCC).
« Raison pour laquelle l’approche néoadjuvante est désormais intégrée dans les recommandations de l’ESMO », commente le Pr Bart Neyns, oncologue médical à l’UZ Brussel et modérateur de la session plénière consacrée aux mélanomes à l’ESMO. « Le KCE plaide aussi d’ailleurs dans ce sens. »
La combinaison ipi + nivo en néoadjuvant
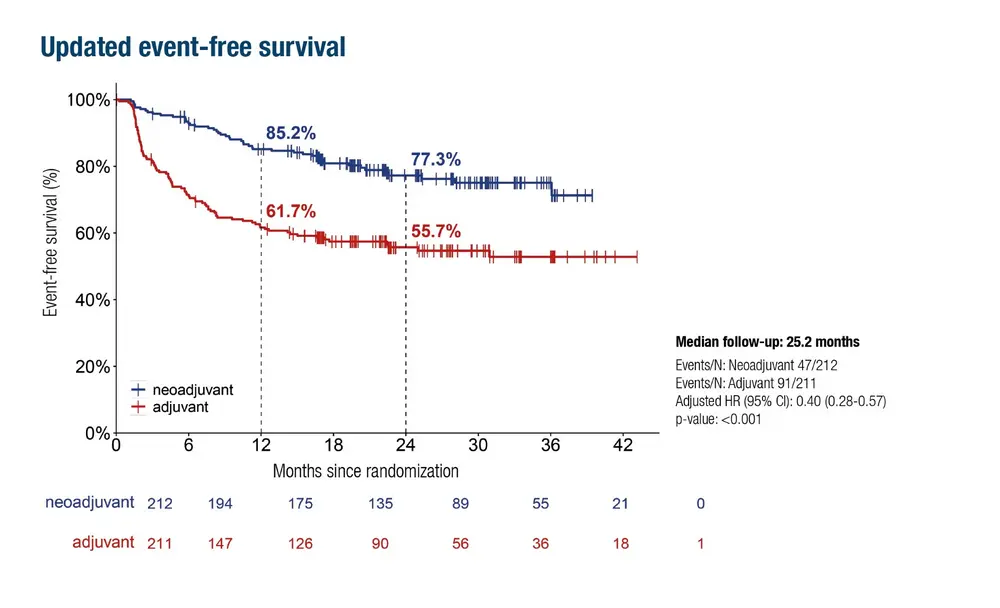
Et pour cause : les récentes données de l’essai de phase III NADINA (Lucas MW et al., ESMO 2025 LBA57) consolident les bénéfices à deux ans d’une stratégie néoadjuvante.
Pour rappel, l’étude compare deux cycles d’ipilimumab + nivolumab, suivis d’une chirurgie (et d’un éventuel adjuvant guidé par la réponse pathologique) à une prise en charge adjuvante standard par nivolumab seul après résection. Résultat au bout de deux ans : la survie sans événement (EFS) est de 77,3 % dans le bras néoadjuvant, contre 55,7 % dans le bras adjuvant [1].
« Soit une différence significative de 21 % entre les deux bras », commente le Pr Neyns. « De plus, sur base de l’analyse anatomopathologique postchirurgicale, 60 % des patients ne présentaient plus de mélanome viable dans la résection après deux cycles d’immunothérapie néoadjuvante. Ces patients n’ont donc reçu aucun adjuvant. Un résultat très élégant ! » Et économiquement avantageux pour la collectivité, puisque l’approche adjuvante se poursuit généralement pendant un an ou jusqu’à rechute ou toxicité inacceptable.
Le pembrolizumab en néoadjuvant
L’ajout de pembrolizumab en néoadjuvant confirme la pertinence de cette stratégie, comme en attestent les résultats actualisés de l’essai SWOG S1801 (Patel SP et al., ESMO 2025, Abstract 1601O).
Cette étude de phase II évalue le pembrolizumab avant et après chirurgie, versus l’adjuvant seul (pembrolizumab) dans des mélanomes de stade III ou IV avec métastases macroscopiques résécables. Avec une EFS à 68 % Vs 56 % et une survie sans récidive (RFS) à 80 % Vs 60 %, le bénéfice à trois ans est confirmé. La survie globale est aussi prometteuse (84 % Vs 73 %), mais devra être confirmée à plus long terme.
« Outre le gain de 15 % entre les deux bras, il faut signaler un degré de toxicités de grade 3-4 assez similaire dans les deux bras : 21 % contre 18 %. Et cette approche néoadjuvante ne reviendrait pas plus chère, puisque le médicament aura déjà été administré pendant neuf semaines avant la chirurgie. »
La combinaison ipi + nivo en adjuvant
Une étude américaine (Mitchell TC et al., ESMO 2025, Abstract 1604O) s’est penchée sur les patients qui n’ont pas eu de réponse pathologique favorable suite à un traitement néoadjuvant par nivolumab - et qui, de ce fait, sont de mauvais pronostics. Les investigateurs ont randomisé ces cas réfractaires en deux bras : le premier a reçu de l’ipilimumab et du nivolumab, et le second du nivolumab seul.
« Étonnamment, la combinaison n’a rien changé à la survie sans récidive – ce qui avait déjà été mis en évidence dans une étude antérieure », commente le Pr Neyns. « Autrement dit, le doublet d’immunothérapies n’est bénéfique qu’en néoadjuvant et quand les métastases (résécables) sont macroscopiques ; en adjuvant, quand les métastases ne sont pas détectables, la combinaison d’immunothérapie n’apporte rien aux patients… sinon des toxicités supplémentaires. »
Car c’est le bémol des traitements combinés. Dans NADINA, des toxicités de grade 3 ou plus ont été observées chez 31,1 % des patients du bras néoadjuvant. Soit presque deux fois plus que dans le bras adjuvant en monothérapie (15,9 %). « Il faudra d’ailleurs informer les patients éligibles à cette combinaison néoadjuvante que le risque de déficit surrénalien définitif est de 7,5 %… contre 2 % en adjuvant. »
Des biomarqueurs prédictifs ?
Mis en balance avec les 60 % de patients qui ont présenté une réponse pathologique complète dans NADINA, le jeu en vaut la chandelle… C’est pour les autres que la prise de risque est plus discutable ! Raison pour laquelle une équipe australienne a essayé d’identifier des biomarqueurs qui pourraient prédire la réponse (complète) à la combinaison néoadjuvante (Pires da Silva I et al., ESMO 2025, Abstract 117MO). Ils en ont analysé trois : le Tumour mutational burden (TMB), le statut BRAF et la signature de l’interféron gamma, lié, entre autres, au PD-L1. Il semblerait qu’une combinaison de deux biomarqueurs prédise une réponse complète… mais seulement dans une fraction de la population étudiée (<10 %).
« La corrélation est intéressante, mais la causalité n’est pas évidente », estime le Pr Neyns. « À ce stade, je vois mal comment nous pourrions appliquer cette recherche de biomarqueurs en clinique. » Cela étant dit, des études sur le sujet sont en cours et pourraient, le cas échéant, ouvrir la voie à une personnalisation accrue des traitements.
Remarque:
1. La survie sans événement lié au mélanome (DFMS) à deux ans - c’est-à-dire l’absence de récidive de la maladie - va dans le même sens : 82,8 % dans le bras néoadjuvant, Vs 63,9 % dans le bras adjuvant.
Un espoir pour le mélanome uvéal avancé réfractaire
Le mélanome de l’œil est rare (5 % des mélanomes), mais il est réputé pour être réfractaire aux traitements, particulièrement quand PRAME est exprimé (90 % des cas).
Or, une étude de phase 1 sur IMA203 (Patel SP et al., ESMO 2025, Abstract 1600O) a démontré des résultats tellement étonnants qu’elle a eu les faveurs d’une session présidentielle à l’ESMO ! Il s’agit d’une thérapie cellulaire TCR dirigée contre PRAME, administrée à une quinzaine de patients déjà traités sans succès. La réponse tumorale (ORR) a été de 67 %, avec une durée médiane de réponse de 11 mois et une survie globale de 16,2 mois. Une réduction tumorale a été observée chez tous les participants.
Ces résultats, très prometteurs, constituent un nouvel espoir pour le mélanome uvéal. Une étude élargie est d’ailleurs en cours de préparation.

