Immunothérapie : comment gérer la toxicité et optimiser la réponse thérapeutique ?
PRATIQUE L’immunothérapie par inhibiteurs de points de contrôle immunitaire (ICI) est aujourd’hui indiquée dans plus d’une vingtaine de types de cancer et constitue une option thérapeutique majeure dans les formes avancées ou métastatiques. Toutefois, les effets indésirables immunomédiés restent fréquents et peuvent encore entraîner des complications importantes chez de nombreux patients. Comment optimiser la gestion de la toxicité des ICI tout en préservant, voire en renforçant, la réponse au traitement ?
La Pre Sandrine Aspeslagh est oncologue médicale à UZ Brussel. Avec sa collègue oncologue, la Dre Marthe Verhaert (AZ Sint-Maria, Halle), elle a développé deux projets ayant pour objectif d’apporter des éléments de réponse à ces questions essentielles.
Le rôle des oncologues a considérablement évolué au cours des dernières décennies. L’émergence de thérapies innovantes s’accompagne de nouveaux enjeux : « Alors qu’autrefois la réflexion se concentrait principalement sur la prolongation de la survie, nous accordons aujourd’hui une attention croissante à l’avenir des survivants du cancer. La qualité de vie occupe désormais une place centrale », souligne la Pre Aspeslagh. « Notre objectif est que les patients puissent suivre leurs traitements dans les meilleures conditions possibles, en limitant autant que possible les séquelles. »

Profil de toxicité
Bien que les ICI soient globalement bien tolérés, l’immunothérapie peut entraîner un spectre très large d’effets indésirables, allant de manifestations aiguës à des toxicités chroniques et des symptômes bénins tels que le prurit, à des complications potentiellement fatales. Les effets indésirables immunomédiés (irAE, immune-related adverse events) peuvent toucher pratiquement tous les organes et se présenter sous forme de syndromes auto-immuns : dermatite, thyroïdite, colite, hépatite, pneumopathie, arthrites, myocardite, myasthénie, etc.
Compte tenu de la grande hétérogénéité de ces toxicités, l’information et la sensibilisation des patients et des professionnels de santé revêtent une importance majeure. Dès qu’une irAE est suspectée, il est recommandé de contacter immédiatement le prescripteur de l’ICI.
La détection précoce et le traitement approprié des toxicités immunomédiées sont essentiels pour prévenir l’apparition de complications prolongées ou plus sévères. Leur prise en charge peut toutefois s’avérer complexe en raison de plusieurs facteurs : présentations atypiques ou rares des irAE, volume limité de données cliniques, absence de recul à long terme, présence d’un trouble immunitaire sous-jacent (également désigné sous le terme de dysimmunité [1]) ou encore possibilité que l’immunosuppression, nécessaire au contrôle des irAE, influence les résultats oncologiques. Dans ce contexte, une coordination étroite entre les prescripteurs d’ICI et les spécialistes des organes est indispensable.
« La détection précoce des toxicités immunomédiées, suivie d’une prise en charge appropriée, est déterminante pour prévenir l’apparition de complications prolongées ou plus sévères. »
Renforcer la collaboration
Faciliter la concertation multidisciplinaire est précisément l’objectif poursuivi par la Pre Sandrine Aspeslagh et son équipe. La Belgian Multidisciplinary Immunotoxicity Board (BITOX) est une plateforme virtuelle bimensuelle réunissant les professionnels de santé souhaitant poser des questions et ceux apportant leur expertise en immunotoxicité liée aux ICI. Actif au niveau national depuis plus de quatre ans, le dispositif suscite un intérêt croissant : environ 450 cas y ont déjà été discutés de manière multidisciplinaire. « Le besoin d’information et de concertation est manifeste », souligne l’oncologue. Dans cette optique, BITOX a également développé l’“Immunomanager”, un outil en ligne dédié à l’orientation et à la prise en charge des irAE [2].
BITOX intervient en soutien à la prise en charge des irAE, notamment lorsqu’elles sont sévères ou réfractaires au traitement. « Prenons l’exemple d’un patient sous immunothérapie dont la fonction rénale se dégrade brutalement et ne s’améliore pas malgré l’administration de corticoïdes : que faire dans une situation pareille ? Nous recevons régulièrement ce type de questions et les examinons avec les spécialistes d’organes concernés, soit en direct lors de nos réunions, soit à distance par e-mail », précise la Pre Aspeslagh.
La seconde question à laquelle BITOX souhaite apporter des éléments de réponse concerne l’utilisation de l’immunothérapie chez les patients cancéreux considérés comme ‘complexes’ [1]. « Dans les essais cliniques, seuls des patients ‘idéaux’ sont inclus et traités par ICI. Les personnes présentant des comorbidités ou des antécédents susceptibles d’augmenter le risque d’irAE en sont systématiquement exclues. Pourtant, dans la pratique, seuls environ 30 % des patients atteints, par exemple, d’un cancer du poumon correspondent à ce profil. Que faire pour les 70 % restants ? Nous évaluons individuellement la possibilité d’administrer une immunothérapie en toute sécurité, en nous appuyant sur les données de la littérature et sur notre expérience clinique », explique-t-elle.
La problématique sensible de l’immunosuppression chez les patients oncologiques fait, elle aussi, l’objet d’une évaluation multidisciplinaire, au même titre que toute question liée aux ICI soulevée par un médecin traitant [3]. « Nos réunions constituent un espace sûr », insiste la spécialiste. « Il n’y a pas de questions stupides. » Une fois l’avis rendu, BITOX assure également un suivi actif du dossier à un, quatre et sept mois.
Rôle du microbiome
Dans un second projet [4], la Pre Aspeslagh et ses collègues s’intéressent au microbiome intestinal des patients atteints de cancer et à la manière dont l’état de santé intestinale influence les résultats de l’immunothérapie. « Une consommation plus importante de fibres alimentaires, ainsi qu’une diversité accrue dans l’alimentation, sont associées à un microbiome plus diversifié et à une meilleure réponse aux ICI. » Plus précisément, cela correspond à l’ingestion hebdomadaire d’au moins 30 plantes différentes (fruits, légumes, légumineuses, graines, noix et céréales).
Les patients inclus dans l’étude FORX [4] reçoivent chaque semaine une box livrée à domicile, composée de 30 plantes de saison et de recettes destinées à faciliter leur consommation. « L’objectif principal est de prévenir l’apparition des irAE. Nous espérons également observer une amélioration de la réponse à l’immunothérapie, conformément aux résultats déjà suggérés par des travaux de recherche antérieurs », indique le Pr Aspeslagh.
Par ailleurs, plusieurs éléments ont été associés, de manière positive ou négative, à la toxicité immunomédiée et à la réponse thérapeutique aux ICI (voir illustration). Par exemple, un traitement antibiotique avant l’initiation de l’immunothérapie est corrélé à des résultats défavorables.
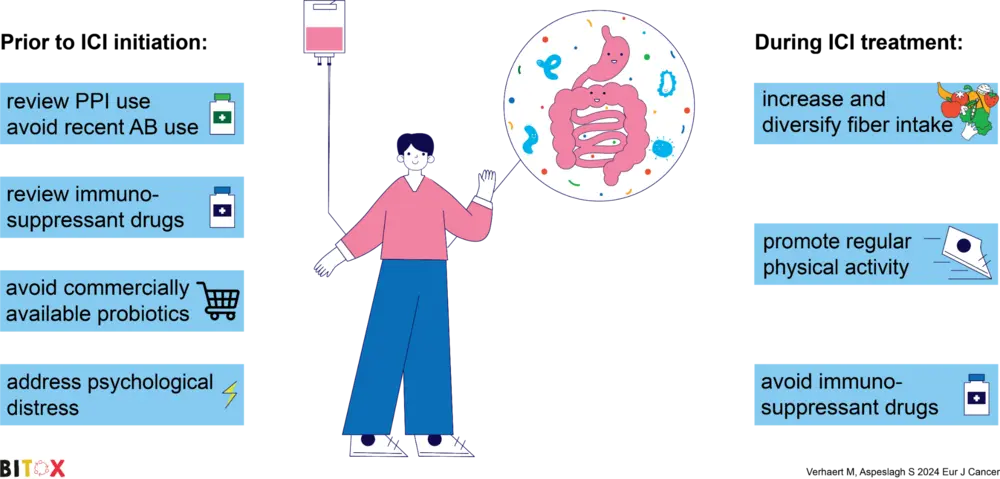
« Patients et cliniciens s’interrogent régulièrement sur les mesures qu’ils peuvent prendre eux-mêmes pour optimiser un traitement par immunothérapie. Nous pouvons désormais formuler une réponse appuyée par des données scientifiques : limiter, lorsque cela est possible, l’usage des antibiotiques, des inhibiteurs de l’acidité gastrique et des immunosuppresseurs (notamment les corticoïdes), ainsi que des probiotiques commerciaux ; maintenir une activité physique suffisante et adopter une alimentation diversifiée et riche en fibres. Ces facteurs exercent un impact direct, et nous observons que les patients sont particulièrement motivés à les appliquer. »
Remarques et références :
1. Il s’agit e.a. de patients souffrant d’une maladie auto-immune, de patients présentant un syndrome paranéoplasique ou ayant déjà développé une irAE, de receveurs d’une transplantation d’organe, de patients traités par antiviraux ou antibiotiques, ou encore de patients vivant avec le VIH.
2. https://bsmo.be/bsmo-bitox-immunomanager/bitox-start/
3. Vous souhaitez soumettre une question ou assister à une réunion pour en apprendre davantage ? Vous pouvez contacter : bitox@bsmo.be.
4. Verhaert M et al. Effects of fiber-rich food on immune checkpoint inhibitor therapy: Findings from the FORX trial. Ann Oncol. 2025 Sep;36(Suppl 2):S1514–S1515. Abstract 2870P.

