Perte de poids : Mounjaro® ▼, le double agoniste GIP/GLP-1 tirzépatide se montre supérieur au sémaglutide*
Comme l’a rappelé Timo Müller (Université Ludwig Maximilian, à Munich), Mounjaro® a la particularité unique d’être un double agoniste des récepteurs GIP et GLP-1, approuvé dans le traitement du diabète de type 2 et de l’obésité. Les premières études SURMOUNT ont notamment montré sa capacité à réduire significativement l'excès pondéral. Présentée lors de la 32e édition de l’ECO (European Congress on Obesity, 11-14 mai 2025, à Malaga), l’étude SURMOUNT-5 (1) allait encore plus loin : dans cette première comparaison directe du genre, Mounjaro® a permis, chez des adultes atteints d’obésité et non diabétiques de type 2, une perte de poids et une réduction du tour de taille significativement supérieure à celles obtenues avec le sémaglutide.*
Menée par Louis Aronne (Comprehensive Weight Control Center au Weill Cornell Medicine, à New York) et son équipe, SURMOUNT-5 était une étude de phase 3b ouverte, randomisée et contrôlée (1). Elle incluait 751 adultes non diabétiques de type 2 mais obèses depuis 16 ans en moyenne, et qui avaient connu au moins un échec antérieur de tentative de réduction pondérale par régime alimentaire. L’âge moyen était de 44,7 ans, et il s’agissait à 64,7% de femmes. Le poids corporel moyen s’élevait à 113,0 kg, avec un IMC moyen de 39,4 kg/m² et un tour de taille moyen de 118,3 cm. A noter également que la moitié de la population étudiée présentaient au moins deux complications liées à leur obésité (hypertension artérielle, dyslipidémie, syndrome des apnées obstructives du sommeil, et/ou maladie cardiovasculaire).
Les participants ont été randomisés pour recevoir pendant 72 semaines soit la dose maximale tolérée de Mounjaro® (10 mg ou 15 mg), soit celle de sémaglutide (1,7 mg ou 2,4 mg) par voie sous-cutanée une fois par semaine. Le critère d'évaluation primaire à la semaine 72 était le pourcentage de variation du poids par rapport à la valeur de départ. Les critères d'évaluation secondaires principaux comprenaient des objectifs de réduction de poids d'au moins 10 %, 15 %, 20 % et 25 %, ainsi que le changement du tour de taille.
Des améliorations significativement plus prononcées
Exprimée en efficacy estimand, la variation du poids à la semaine 72 était de -21,6 % avec le Mounjaro® MTD (a) et de -15,4 % avec le sémaglutide (b), soit une perte 47 % plus prononcée avec le tirzépatide. Quant au tour de taille, qui reflète généralement le niveau de l’obésité viscérale, sa diminution moyenne s’élevait à 20,0 cm (c) avec le Mounjaro® MTD et à 14,7 cm avec le sémaglutide MTD (d) – soit une diminution 42 % plus importante avec le Mounjaro®. De manière analogue, l’IMC avait baissé de 8,5 avec le Mounjaro® contre 6,0 avec le sémaglutide .
a: IC 95% : -22,8 à -20,5 ; p < 0,001,
b : IC 95% : -16,6 à -14,3 ; p < 0,001,
c : IC 95% : 18,8 à 21,2 ; p < 0,001,
d : IC 95% : 13,5 à 15,9 ; p < 0,01
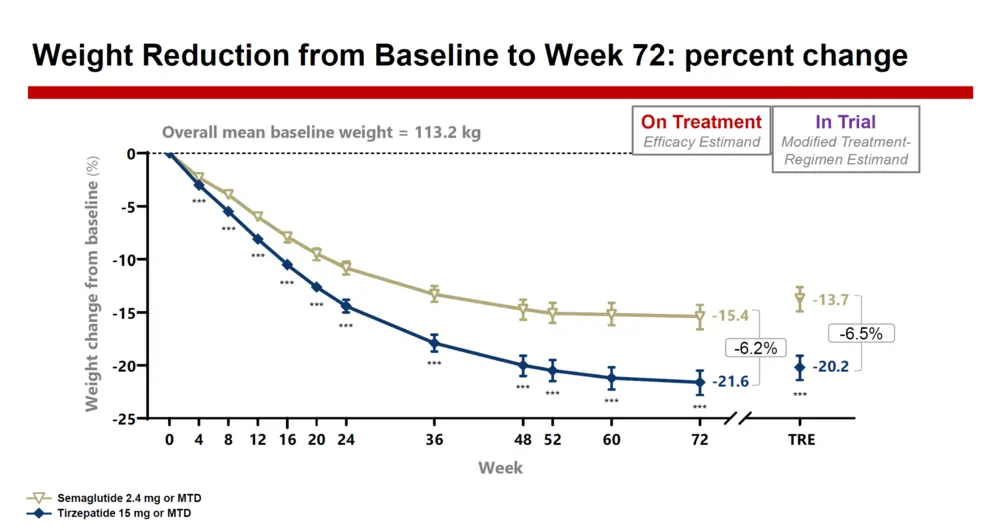
Data from Aronne LJ, et al. N Engl J Med 2025; in press.
Louis Aronne rappelle que les deux dernières décennies ont montré la possibilité de surmonter l’effet de plateau généralement observé avec les produits classiquement disponibles pour lutter contre l’obésité « en utilisant des médicaments qui agissent par des mécanismes complètement différents, et c’est exactement ce qui a été observé dans SURMOUNT-5, avec une perte de poids supplémentaire. » (1)
L’amélioration de la perte pondérale pouvait être exprimée autrement : en comparaison avec les participants du groupe sémaglutide, les participants traités par Mounjaro® étaient respectivement environ 30 %, 60 %, 80 % et deux fois plus susceptibles d’obtenir une perte pondérale s’élevant à 10 %, 15 %, 20 % et 25 %. Un autre chiffre éloquent : 19,7 % des participants du groupe tirzépatide ont vu leur poids corporel baisser d’au moins 30 %, versus 6,9 % dans le groupe sémaglutide, soit 2,8 fois plus.(1)
Des répercussions cardiométaboliques favorables
À la semaine 72, une amélioration des paramètres cardiométaboliques a été observée avec le traitement par Mounjaro® et par sémaglutide, de façon consistante avec les études déjà publiées. (1)
L’amélioration était également plus forte avec le tirzépatide sur le plan de paramètres cardiovasculaires comme la pression artérielle, comme l’a montré l’analyse post-hoc de SURMOUNT-5 qu’a réalisé l’équipe de Carel le Roux (Dublin) : si les participants du groupe tirzépatide et du groupe sémaglutide étaient respectivement 34% et 29% à présenter des chiffres < 130/80 mmHg au départ, ils étaient 61% et 52% à la semaine 72.
Une sécurité rassurante
Les effets indésirables les plus fréquents étaient de type gastro-intestinal et d’intensité légère à modérée survenaient principalement pendant la phase d’augmentation des doses des deux médicaments comparés. Louis Aronne estime que le taux d’interruption du traitement dû à des effets indésirables était très faible, se chiffrant à 6,1 % dans le groupe tirzépatide et à 8,0 % dans le groupe sémaglutide.
Il convient également de noter que le suivi de 72 semaines ne délivrait pas nécessairement des chiffres définitifs en termes d’efficacité, comme l’a rappelé Carel le Roux. L’étude de Horn et al (2) a en effet montré qu’entre 10 et 30% de ses participants placés sous Mounjaro® n’avaient pas (encore) atteint le plateau pondéral à la semaine 72.
*Mounjaro MTD (10 mg ou 15 mg) versus sémaglutide MTD (1,7 mg ou 2,4 mg)
RP: Eli Lilly Benelux - Markiesstraat 1/4B Rue du Marquis, 1000 Brussel/Bruxelles. Copyright (2025)
Ce matériel est réservé aux personnes habilitées légalement à prescrire ou délivrer des médicaments.
PP-TR-BE-0412 – May 2025
Références :
1. Aronne LJ, Horn DB, le Roux CW, Ho W, Falcon BL, Gomez Valderas E, Das S, Lee CJ, Glass LC, Senyucel C, Dunn JP; SURMOUNT-5 Trial Investigators. Tirzepatide as Compared with Semaglutide for the Treatment of Obesity. N Engl J Med. 2025 May 11. doi: 10.1056/NEJMoa2416394. Epub ahead of print
2. Horn DB, et al. Clinical Obesity. 2025;e12734
▼Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.









